Статья в журнале "Наноиндустрия" №13 "Многоканальные оптоволоконные нейроинтерфейсы"
Принципиальные возможности разработки нейроэлектронных интерфейсов
Нейроэлектронный многоканальный интерфейс
Нейроэлектронный многоканальный оптоволоконный интерфейс
Принципиальные возможности разработки нейроэлектронных интерфейсов
Нейроинтерфейсы на основе ИМКС
Создание многоконтактных нейроэлектронных интерфейсов - важнейшая проблема нейрокибернетики.

В нервах человека находятся десятки и сотни тысяч проводящих нервных волокон. Кроме ИМКС никаким другим способом невозможно осуществлять полноценные соединения с такими структурами.
Наименование нерва |
Примерное количество нервных волокон |
Берцовый нерв |
56 тысяч |
Слуховой нерв |
200 тысяч |
Зрительный нерв |
1,0 миллион |
Спинной мозг |
10,0 миллион |
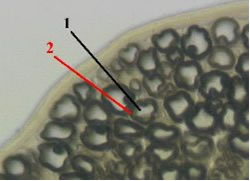
 |
1- осевой цилиндр; 2 - миелиновый слой; |
Справочные данные взяты с www.vetfak.nsau.edu.ru/new/uchebnic/histology
Нейроэлектронный многоканальный интерфейс
Изобретения относятся к соединению устройств ввода-вывода или устройств центрального процессора или передаче информации или других сигналов между этими устройствами.
Изобретения также относятся к измерениям для диагностических целей, а именно к входным цепям, специально предназначенным для этой цели, а также к средствам нейропротезирования.
Уровень техники
Известно использование заостренных проводников или электродов, размещенных в стеклянных микропипетка для записи сигналов нервных клеток. Для этих же целей используют стеклянные капилляры заполненные электролитом диаметром в несколько микрон. Они обычно используются как внутриклеточные электроды, для измерения потенциала в пределах одной клетки. Обычно такие электроды делаются вручную.
Известны многоканальные реализации таких устройств. Обычно они содержат от 8 до 32 микропроводов диаметром в 50 микрон из вольфрама или нержавеющей стали, изолированных полиимидом или тефлоном. Провода обычно размещены в массиве 2 на 8 проводов. Провода имплантируются в мозг, а разъем крепится к черепу акриловым клеем. Для сравнения средний д иаметр одного нейрона примерно равен 60 микронам, а размер синаптических контактов составляет 0.1-0.5 микрона. Следовательно, микропровод диаметром 50 микрон практически полностью разрушает нейрон, если проникает в него. Нейроимпульсы, снятые такими устройствами, в большинстве случаев носят интегральный характер и должны относиться к локальной области нейронов.
Обычно микропровода обеспечивают жизнеспособность интерфейса и возможность записи в течение одного-двух месяцев.
Известны многоканальные устройства содержащие, электроды, размещенные в стеклянных микропипетках, заполненных жидкими проводящими веществами, способствующими росту нейронов. Такие устройства оказались жизнеспособными до 16 месяцев.
Известны многоканальные нервные интерфейсы, предназначенные для имплантации на поверхность мозга или периферийных нервов. Они ограниченны возможностью записи сигналов из массивов нейронов, расположенных на поверхности мозга, не глубже 5 мм. Для высокоразвитых млекопитающих они позволяют осуществлять записи из неокортекса, периферийных нервов или других поверхностных структур. Однако это тоже устройства изготавливаемые вручную. Для массовых применений с развитием технологий изготовления микросхем стали появляться многоканальные устройства для соединения с нервными клетками, изготовленные на кремниевых подложках, которые называют нейрочипами.
В принципе, проблема создания проводящего двустороннего интерфейса между нейроном и полупроводником может быть решена с использованием принципа электрической поляризации диэлектриков [40-43]. « Если соединить нейрон и полупроводник таким образом, что непроводящая липидная мембрана будет находиться в прямом контакте с изолирующим слоем диоксида кремния, расположенном на поверхности p-n перехода, то можно получить желаемый двусторонний интерфейс. Благодаря активности нервной клетки на слой диэлектриков действует слабое электрическое поле, которое их поляризует. Прямая поляризация определяет перенос зарядов транзистора, расположенного под слоем диоксида кремния, в направлении исток-сток. С этого и начинается взаимодействие чипа и нейрона. Обратная связь достигается тем же эффектом поляризации: электрическое поле, генерируемое транзистором, поляризует мембрану нейрона, что заставляет открываться и закрываться ионные каналы, управляемые чувствительными к электрическому полю белками.
В 1999 году, исследователи из Института им. Макса Планка попытались создать подобный чип, расположив на поверхности матрицы транзисторов отдельный нейрон крысы. Нервная клетка диаметром около 20 микрон и с толщиной липидной двухслойной мембраны в 5 нанометров была помещена на матрицу транзисторов, покрытых слоем диоксида кремния. Поверхность диоксида кремния оказалась чрезвычайно биосовместимой с живой клеткой. Весь чип находился в растворе электролита. Нейрон культивировался на поверхности чипа in vitro в течение трех дней.
Описанный выше нейроинтерфейс может является основой любых гибридных нейроэлектронных цепей. Для успешного построения гибридных цепей, работающих с несколькими нейронами, необходимо создать чип, который будет управлять передачей информации между ними. Для этого ученые создали гибридное электронное устройство, связывающее два нейрона между собой и позволяющее им обмениваться информацией. Размер полученного ими нейрочипа достаточно велик — около 300 микрон. Диаметр одного нейрона — 60 микрон».
Аналоги
Одно из вышеперечисленных устройств описано в патенте США по заявке № 20060276866 « Microelectrode array for chronic deep - brain microstimulation for recording » (« Массив микроэлектродов для глубокой мозговой микростимуляции и записи»). Изобретение относится к микроэлектродам, имеющим кремниевую подложку и многочисленные проводящие электроды для глубокого мозгового электрического стимулирования или записи нервных сигналов. Подложка имеет верхний конец с многочисленными проводящими частями для соединения. Изобретение включает тонкопленочную основную полимерную подложку, которая может быть достаточно гибкой, чтобы следовать за 3-х мерными контурами биологической системы. Многочисленные каналы и места электродов могут точно быть установлены на одном устройстве для местной доставки лекарств или записи или стимулирования нейронов. Устройство содержит массив электрических контактов и встроенный кабель для разъема. Такие устройства изготавливают методами массового производства микросхем, и они могут быть достаточно дешевы. Однако проблема с вживляемостью и сроком службы ограничивает их широкое применение, несмотря на использование губчатой платины, проводящих полимеров и высокостойких полимерных покрытий.
В патенте США по заявке № 20060241753 описывается многоканальное устройство для соединения с нейронами сетчатки глаза для протезирования зрения, использующее 98 каналов. Однако качество такого протезирования недостаточно. Зрительный нерв здорового глаза содержит приблизительно один миллион индивидуальных волокон. По каждому волокну могут передаваться сигналы с частотой до 200 герц. Это эквивалентно информационному потоку в 200 Мегабит в секунду. Создавать подобный канал на основе электрических электродов нецелесообразно. Кроме проблем с изготовлением и изоляцией сверхтонких электрических проводников и их селективным подключением здесь возникают еще более трудные проблемы с вживляемостью целого миллиона электродов, которые при передаче электрических импульсов будут работать как микроэлектролизеры, разлагая физиологические среды мозга на водной основе и разлагаясь сами. Это неизбежно приведет к возникновению аллергических реакций и отторжению системы. Если обеспечение приживаемости и длительной работоспособности в сложной физиологической среде мозга для сотен металлических электродов почти не решаемая задача, то для миллионов таких электродов это технологический тупик.
Известен гибкий полимерный микроэлектрод с жидкостным передающим каналом и способ его получения по заявке США № 20060282014 « Flexible polymer microelectrode with fluid delivery capability and methods for making same ». Это изобретение включает микроэлектроды, по крайней мере, с одним слоем микроэлектродов между, по крайней мере, двумя слоями многослойной полимерной подложки, причем, по крайней мере, один электродный слой содержит каналы для поступления жидкости в нервную систему.
Теперь зададимся вопросом: как мы собираемся проделать эту операцию и ничего не повредить? Ответ: нужно послать сканеры внутрь мозга. Наши капилляры устроены так, что они проходят через каждое межнейронное соединение, каждый нейрон и каждый элемент нейрона. Мы можем отправить туда миллиарды сканирующих роботов, объединенных в одну беспроводную локальную сеть, чтобы они смогли отсканировать мозг изнутри и начертить карту с высоким разрешением, отражающую все, что происходит внутри.
Для полного погружения в виртуальную реальность мы направим в мозг миллиарды этих нанороботов с тем, чтобы они разместились у каждого нервного волокна, исходящего от всех наших органов чувств. Если вы захотите остаться в подлинной реальности, они будут просто сидеть на своих местах и ничего не делать. Если вы захотите перейти в виртуальную реальность, они начнут подавлять сигналы, поступающие от ваших настоящих органов чувств, и станут заменять их сигналами, которые вы бы получали, находясь в виртуальной среде.
При такой схеме мы будем получать виртуальную реальность изнутри, и она сможет воспроизводить все наши ощущения. Это будет коллективная среда, в которую можно будет войти и одному человеку, и многим людям. Посещение какого-нибудь web-сайта будет означать попадание в среду виртуальной реальности, охватывающую все наши чувства, причем не только поступающие от пяти основных чувств, но и эмоции, сексуальное удовлетворение, юмор. На самом деле неврологические корреляты всех этих ощущений и эмоций, которые я обсуждаю в книге "Эпоха одухотворенных машин" ("The Age of the Spiritual Machines"), уже существуют.
Используя имплантанты на основе нанороботов, мы сможем усиливать или ослаблять наши эмоциональные реакции на различные переживания. Эта возможность лежит на поверхности. Кроме того, вы сможете иметь несколько тел для разных переживаний. Как сегодня люди передают свои изображения при помощи web-камер, установленных у них в квартирах, так можно будет направлять на себя весь поток ощущений и даже эмоций из Интернета, так что вы сможете, как в фильме "Быть Джоном Малковичем", переживать жизнь других людей".
Нечто подобное описано в патенте США по заявке № 20060293578 «Brian machine interface device» (Устройство для соединения мозга и машины). По этому патенту распределенный и работающий в режиме реального времени нейроинтерфейс содержит считыватель и массив устройств записи. Считыватель излучает и получает радиочастотные сигналы. Массив записывающих устройств включает беспроводную секцию и сенсорную секцию. Беспроводная секции включает преобразователь, антенну и модулятор. Преобразователь преобразует радиочастотный сигнал. Сенсорная секция принимает стабильные силовые сигналы. Сенсорная секция приспособлена для обнаружения нервной деятельности и выдает выходные сигналы, содержащие информацию, указывающую на такую нервную деятельность модулятору беспроводной секции, посредством чего модулятор передает информацию на выходные сигналы считывателя.
Недостатком описанных устройств является чрезвычайная сложность осуществления, недоступная современному уровню развития техники.
Известен патент США по заявке № 20060282014 « Flexible polymer microelectrode with fluid delivery capability and methods for making same » по которому микроэлектрод содержит кремниевую подложку, массив микроэлектродов и слои полимерных подложек.
Недостатком такого решения является небольшая область применения, ограниченная возможностью соединения с группами нейронов, расположенных только на поверхности нейроструктур.
Прототип
Прототипом заявляемого изобретения является нейроэлектронный интерфейс, действующий на основе принципа электрической поляризации липидной мембраны нейрона через слой диэлектрика, описанный в [40-43], а точнее его разновидность, действующая через слой электролита. В этом интерфейсе нейрон и полупроводник соединены таким образом, что непроводящая липидная мембрана нейрона контактирует через слой электролита (физиологической межклеточной жидкости) с изолирующим слоем диоксида кремния, расположенном на поверхности p-n перехода чувствительного транзистора. Электрическое поле, генерируемое транзистором, поляризует мембрану нейрона, что заставляет открываться и закрываться ионные каналы, управляемые чувствительными к электрическому полю белками. При наличии слоя электролита между мембраной нейрона и слоем диоксида кремния, протекание тока через мембрану нейрона приводит к появлению переносного внеклеточного потенциала в слое электролита, который поляризует слой оксида, позволяя нейрону взаимодействовать с p-n переходом. И наоборот, этот же потенциал приводит к поляризации мембраны клетки, когда напряжение подается на транзистор. Исследователям из Института им. Макса Планка удалость экспериментально подтвердить факт, что внутриклеточный потенциал и соответствующий ему ток, походящий через клеточную мембрану, вызывает ответное изменение внеклеточного потенциала, который повторяется транзистором.
В этих же источниках описана работа искусственных синапсов, работающих по такому же поляризационному принципу, которые успешно взаимодействовали с реальными живыми нейронами.
Однако, тот факт, что нейроны взаимодействуют с поляризованными объектами, ограничивает возможность передачи информации с помощью изолированных электрических проводников вглубь мозга. Так как сам по себе такой проводник уже будет являться поляризатором, то все области нейронов, через которые проходит этот проводник, будут обязательно возбуждены при передаче электрического импульса через него. Это приведет к нежелательным эффектам при передаче информации в мозг. Таким образом, изолированный электрический проводник является слишком грубым средством для передачи информации и не может быть использован для передачи информации в глубинные структуры мозга без достаточно толстой изоляции.
Концепция Р. Пенроуза и С. Гамерова
Согласно концепции Р. Пенроуза и С. Гамерова [46] нейроны являются не первичными переключателями нервных сигналов, а сложными вычислительными устройствами, математический процесс в которых осуществляется с помощью массивов молекул протеина тубулин, составляющих стенки микротрубочек цитоскелета нейрона.
При электронной микроскопии в отростках нейронов обнаружены два рода продольно ориентированных нейрофибрилл: трубчатые (диаметр 20—25 нм), так называемые нейротубулы, построенные из белка тубулина и, как полагают, обеспечивающие транспорт веществ по аксону, и нитевидные (диаметр 10 нм), так называемые нейрофиламенты, построенные из белка, близкого к мышечному белку актину; нейрофиламенты особенно многочисленны в подвижных концевых участках растущих аксонов.
Традиционно микротрубочки рассматриваются как чисто структурные элементы. Недавно найденные свидетельства [46] показали, что кроме того, имеет место механическая передача сигнала и коммуникативные функции:
- Микротрубочки нейрона "спазматически" перемещаются по 15 микрон (2000 тубулинов) в секунду. Vernon and Woolley (1995) Experimental Cell Research 220(2)482-494
- Микротрубочки нейрона вибрируют (100-650 Гц) со смещением 1 нм. Yagi, Kamimura, Kaniya (1994) Cell motility and the cytoskeleton 29:177-185
- Микротрубочки нейрона оптически "мерцают" при метаболической активности. Hunt and Stebbings (1994), Cell motility and the cytoskeleton 17:69-78
- Через микротрубочки нейрона проходят сигналы в клеточное ядро; имеется механизм MT -регуляции экспрессии генов. Maniotis, Chen and Ingber (1996) Proc. Natl. Acad. Sci. USA 94:849-854
- Измеренный диполь тубулина и проводимости микротрубочек подтверждает, что микротрубочки являются ферроэлектриками при физиологической температуре (Tuszynski; Unger 1998)
Настоящие модели предполагают, что тубулины в микротрубочках испытывают когерентное возбуждение, переключаясь между двумя или более конформационными состояниями за несколько наносекунд. Дипольные связи между соседними тубулинами в решетке микротрубочки образуют динамические паттерны, или "автомат", которые эволюционируют, взаимодействуют между собой и ведут к образованию новых паттернов. Исследования показывают, что микротрубочковый автомат может проводить вычисления, поддерживающие классическую обработку информации, ее передачу и обучение внутри нейронов».
«Идея микротрубочного автомата предлагает огромное увеличение вычислительных возможностей мозга. Общепринятые подходы фокусируют внимание на синаптических переключениях на нейронном уровне, которые дают около 10 18 операций в секунду в человеческом мозге (~10 11 нейронов в мозге, ~10 4 синапсов/нейрон, переключающихся с частотой ~10 3 сек -1). Микротрубочный автомат может дать около10 27 операций в секунду (~10 11 нейронов с ~10 7 тубулинов/нейрон, переключающихся с частотой ~10 9 сек -1). Тот факт, что все биологические клетки содержат приблизительно 10 7 молекул тубулинов, может быть причиной адаптивного поведения одноклеточных организмов, которые не имеют нейронной системы или синапсов. Нейроны являются не переключателями, а сложными компьютерами».
Традиционно считается, что передача нервных сигналов между нейронами осуществляется либо с помощью нейромедиаторов, либо непосредственно электрическим путем [47-49]. Однако до появления современных теорий существовала биогидравлическая модель нервных систем [50]. Она была выдвинута известным греческим мыслителем Аристотелем (384-322 до н.э.) и поддерживалась великим французским ученым Декартом (1596-1650. Ряд специфических факторов в работе нервных систем и мозга свидетельствует в пользу биогидравлической модели. «Скорость перемещения называемого потенциала действия нервного импульса больше соответствует скорости распространения волны давления в вязкой жидкости и совсем не соответствует скорости распространения электричества. В коротких нервных клетках электрический потенциал действия не регистрируется. Только эластичные гидравлические каналы, какими являются каналы нервных клеток, нуждаются в упрочнении их оболочек миелином, так как оно способствует повышению скорости распространения потенциала действия, то есть волны давления. Разрушение миелиновых оболочек, как форма болезни, приводит к нестабильности, в движениях человека; скорость перемещения импульсов по нейронам прямо зависит от диаметра аксона, и даже такой общеизвестный факт, как вздрагивание ноги при ударе молоточком по колену, говорит в пользу гидравлических процессов [50]».
Концепция Р. Пенроуза и С. Гамерова позволяет предположить, что для создания нейроэлектронных интерфейсов с достаточно сложными и умными наноструктурами, которыми являются нейроны, не обязательно использовать чисто электрические или электрохимические средства. Есть достаточно много оснований считать, что передача информации между нейронами может осуществляться и на основе волнового взаимодействия. Нейроны могут «слышать» звуковые волны и реагировать на инфра- или ультразвуковые колебания жидкости в окружающей их жидкостной среде. Учитывая общеизвестный факт, что белок миелин, из которого построены элементы цитоскелета нейрона, и ряд других веществ, входящих в состав цитоскелета нейрона, обладают слабыми пьезоэлектрическими свойствами, становится понятным, что любые колебания жидкости возле нейрона приводят к деформации элементов цитоскелета и возникновению в них электрических полей. Причем напряженность электрического полей при пьезоэффекте зависит от скорости нарастания деформации. Именно этим фактором можно легко объяснить известное всем явление высокой интенсивности болевых ощущений при быстром ударном механическом воздействии на любое нервное скопление, в том числе и на мозг. При медленном нагружении пьезоэффект слаб, и боли не возникает. Следовательно, вибрации и звуковые колебания в жидкости могут быть использованы для создания нейроэлектронных интерфейсов.
Краткое описание чертежей
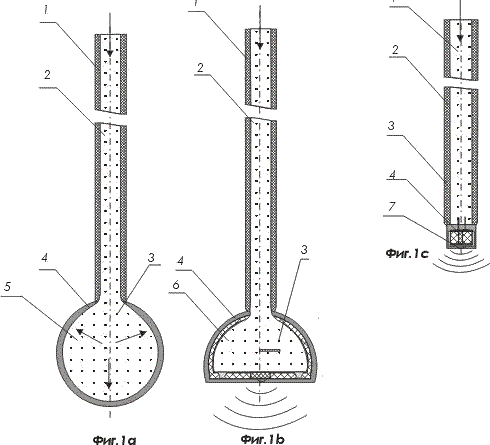
На фигурах 1а, 1в и 1с показаны варианты световодов с различными наконечниками
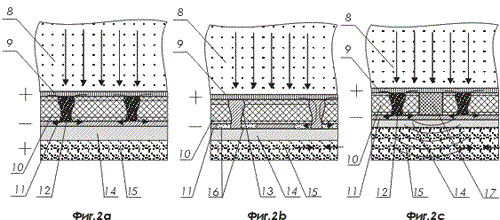
На фигурах 2а, 2в и 2с показаны варианты активных наноструктур, размещенных на наконечниках световодов
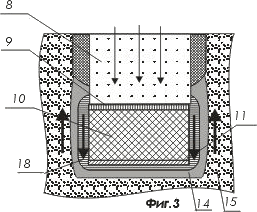
На фигуре 3 показан вариант активной наноструктуры с пьезоэлектрическим интерфейсом
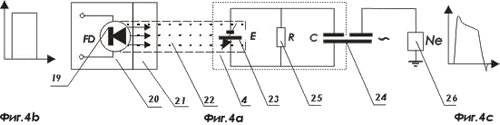
На фигуре 4а, 4 b и 4 c показана принципиальная электрическая схема нейроэлектронного интерфейса на основе поляризационного принципа возбуждения нейрона
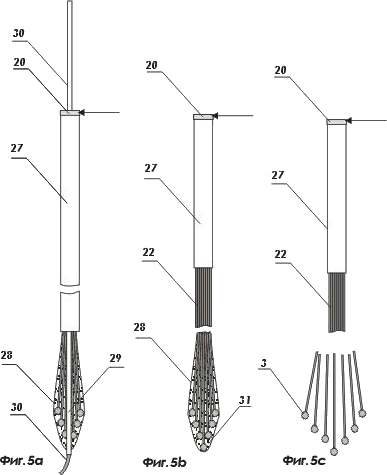
На фигурах 5а, 5в и 5с показаны варианты наконечников пакетов световодов
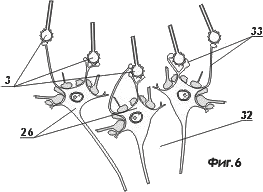
На фигуре 6 показана нейроструктура, соединенная с биокибернетическим многоканальным интерфейсом после растворения оболочки пакета световодов
На фигурах 1 – 6 цифрами обозначены:
- волоконно-оптический световод ;
- оболочка волоконно-оптического световода ;
- наконечник волоконно-оптического световода ;
- активная наноструктура;
- сферический наконечник;
- полусферический наконечник;
- прямой торцевой наконечник;
- материал световода, стекло, оптический пластик;
- первый внутренний полупрозрачный проводящий слой, например, из проводящего оксида, например SnO2 , In2O3;
- один или несколько слоев фотоэлектрического вещества, например, медь-индий-диселенид галлия CuInSe2 или аморфного кремния или арсенида галлия;
- второй внешний проводящий слой, например, металла;
- канал, в слое фотоэлектрического вещества соединяющий проводящие слои и заполненный резистивным веществом;
- канал в слое фотоэлектрического вещества, заполненный проводником и соединенный с первым проводящим слоем;
- внешний слой диэлектрика, например, диоксида кремния;
- электролит, межнейронная жидкость ;
- концентрическая область резистивного вещества во втором внешнем проводящем слое, окружающая канал в слое фотоэлектрического вещества, заполненный проводником и соединенный с первым проводящим слоем;
- область, заполненная пьезоэлектрическим веществом, например, диоксидом кремния или титанатом бария;
- соединение проводящих слоев резистивным материалом, осуществленное по периметру границ проводящих слоев или по боковой поверхности световода;
- излучающая ячейка, например, фотодиод, плоской оптической матрицы ИМКС;
- многоканальная матрица оптических излучателей ИМКС;
- многоканальный оптоволоконный разъем в виде плоской оптической матрицы световодов снабженных механическим устройством для соединения с многоканальная матрицей оптических излучателей ИМКС;
- пакет оптических волоконных световодов;
- фотоэлектрический преобразователь, который преобразует свет в электрический импульс;
- средство возбуждения нейрона путем электрической поляризации его мембраны или путем волнового воздействия;
- область резистивного материала ;
- нейрон;
- внешняя сплошная оболочка пакета световодов;
- наконечник обтекаемой или заостренной формы;
- канал пакета оптических волоконных световодов для видеоустройств или иных вспомогательных приспособлений;
- управляющий катетер ;
- растворимое или рассасывающееся вещество, например, модифицированный коллаген, содержащий лекарственные препараты, например, аминокислоты, нейропептиды, нуклеозиды и витамины различного назначения и т.п.;
- нейронная структура;
- синапс.
Осуществление изобретения
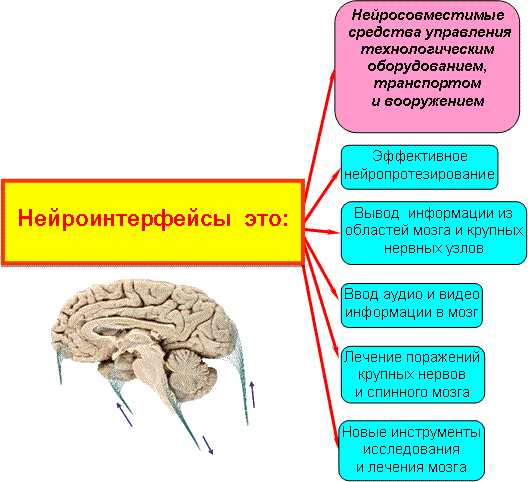
Предлагаемый нейроэлектронный интерфейс позволяет решить целый ряд важнейших проблем связанных с возможностью протезирования органов зрения и слуха, реабилитации парализованных, лечения серьезных психических заболеваний, связанных с необходимостью тонкого стимулирования по заданной программе или, наоборот, тонкого частичного угнетения в определенные периоды времени определенных, достаточно больших групп нейронов, например, при эпилепсии и шизофрении.
Перспективно применение предлагаемого изобретения для стимулирования глубоких областей мозга, ответственных за производство гормонов, управляющих развитием организма. Это важно, например, при церебральном параличе.
Синхронно стимулируя определенные области гипофиза и других областей мозга, можно добиться увеличения синтеза «гормонов молодости», восстановления многих утраченных или ослабленных физиологических функций организма, а это путь к лечению многих болезней старости, продлению жизни и развитию творческих и физических способностей организма.
Создание эффективных нейроэлектронных интерфейсов позволит иметь мощнейшие средства для управления сложными и простыми живыми существами, для усиления возможностей и способностей людей и животных.
Нейроэлектронный многоканальный оптоволоконный интерфейс
Изобретение относится к соединению устройств ввода-вывода или устройств центрального процессора или передаче информации или других сигналов между этими устройствами.
Изобретения также относятся к измерениям для диагностических целей, а именно к входным цепям, специально предназначенным для этой цели, а также к средствам нейропротезирования.
Уровень техники
Известно использование заостренных проводников или электродов, размещенных в стеклянных микропипетка для записи сигналов нервных клеток. Для этих же целей используют стеклянные капилляры заполненные электролитом диаметром в несколько микрон. Они обычно используются как внутриклеточные электроды, для измерения потенциала в пределах одной клетки. Обычно такие электроды делаются вручную.
Известны многоканальные реализации таких устройств. Обычно они содержат от 8 до 32 микропроводов диаметром в 50 микрон из вольфрама или нержавеющей стали, изолированных полиимидом или тефлоном. Провода обычно размещены в массиве 2 на 8 проводов. Провода имплантируются в мозг, а разъем крепится к черепу акриловым клеем. Для сравнения средний диаметр одного нейрона примерно равен 60 микронам, а размер синаптических контактов составляет 0.1-0.5 микрона. Следовательно, микропровод диаметром 50 микрон практически полностью разрушает нейрон, если проникает в него. Нейроимпульсы, снятые такими устройствами, в большинстве случаев носят интегральный характер и должны относиться к локальной области нейронов.
Обычно микропровода обеспечивают жизнеспособность интефейса и возможность записи в течение одного-двух месяцев.
Известны многоканальные устройства, содержащие электроды, размещенные в стеклянных микропипетках, заполненных жидкими проводящими веществами, способствующими росту нейронов. Такие устройства оказались жизнеспособными до 16 месяцев.
Известны многоканальные нервные интерфейсы, предназначенные для имплантации на поверхность мозга или периферийных нервов. Они ограничены возможностью записи сигналов из массивов нейронов, расположенных на поверхности мозга, не глубже 5 мм. Для высокоразвитых млекопитающих они позволяют осуществлять записи из неокортекса, периферийных нервов или других поверхностных структур. Однако это тоже устройства, изготавливаемые вручную. Для массовых применений с развитием технологий изготовления микросхем стали появляться многоканальные устройства для соединения с нервными клетками, изготовленные на кремниевых подложках, которые называют нейрочипами.
Аналоги
Одно из таких устройств описано в патенте США по заявке № 20060276866 « Microelectrode array for chronic deep - brain microstimulation for recording » (« Массив микроэлектродов для глубокой мозговой микростимуляции и записи»). Изобретение относится к микроэлектродам, имеющим кремниевую подложку и многочисленные проводящие электроды для глубокого мозгового электрического стимулирования или записи нервных сигналов. Подложка имеет верхний конец с многочисленными проводящими частями для соединения. Изобретение включает тонкопленочную основную полимерную подложку, которая может быть достаточно гибкой, чтобы следовать за 3-х мерными контурами биологической системы. Многочисленные каналы и места электродов могут точно быть установлены на одном устройстве для местной доставки лекарств или записи или стимулирования нейронов. Устройство содержит массив электрических контактов и встроенный кабель для разъема. Такие устройства изготавливают методами массового производства микросхем, и они могут быть достаточно дешевы. Однако проблема с вживляемостью и сроком службы ограничивает их широкое применение, несмотря на использование губчатой платины, проводящих полимеров и высокостойких полимерных покрытий.
В патенте США по заявке № 20060241753 описывается многоканальное устройство для соединения с нейронами сетчатки глаза для протезирования зрения, использующее 98 каналов. Однако качество такого протезирования недостаточно. Зрительный нерв здорового глаза содержит приблизительно один миллион индивидуальных волокон. По каждому волокну могут передаваться сигналы с частотой до 200 герц. Это эквивалентно информационному потоку в 200 Мегабит в секунду. Создавать подобный канал на основе электрических электродов нецелесообразно. Кроме проблем с изготовлением и изоляцией сверхтонких электрических проводников и их селективным подключением здесь возникают еще более трудные проблемы с вживляемостью целого миллиона электродов, которые при передаче электрических импульсов будут работать как микроэлектролизеры, разлагая физиологические среды мозга на водной основе и разлагаясь сами. Это неизбежно приведет к возникновению аллергических реакций и отторжению системы. Если обеспечение приживаемости и длительной работоспособности в сложной физиологической среде мозга для сотен металлических электродов почти не решаемая задача, то для миллионов таких электродов это технологический тупик.
Известен гибкий полимерный микроэлектрод с жидкостным передающим каналом и способ его получения по заявке США № 20060282014 « Flexible polymer microelectrode with fluid delivery capability and methods for making same ». Это изобретение включает микроэлектроды, по крайней мере, с одним слоем микроэлектродов между, по крайней мере, двумя слоями многослойной полимерной подложки, причем, по крайней мере, один электродный слой содержит каналы для поступления жидкости в нервную систему.
Известен интерфейс по заявке США № 20060293578 «Brian machine interface device» (Устройство для соединения мозга и машины). По этому патенту распределенный и работающий в режиме реального времени нейроинтерфейс содержит считыватель и массив устройств записи. Считыватель излучает и получает радиочастотные сигналы. Массив записывающих устройств включает беспроводную секцию и сенсорную секцию. Беспроводная секции включает преобразователь, антенну и модулятор. Преобразователь преобразует радиочастотный сигнал. Сенсорная секция принимает стабильные силовые сигналы. Сенсорная секция приспособлена для обнаружения нервной деятельности и выдает выходные сигналы, содержащие информацию, указывающую на такую нервную деятельность модулятору беспроводной секции, посредством чего модулятор передает информацию на выходные сигналы считывателя.
Недостатком описанных устройств является чрезвычайная сложность осуществления, недоступная современному уровню развития техники.
Известен патент США по заявке № 20060282014 « Flexible polymer microelectrode with fluid delivery capability and methods for making same » по которому микроэлектрод содержит кремниевую подложку, массив микроэлектродов и слои полимерных подложек.
Недостатком такого решения является небольшая область применения, ограниченная возможностью соединения с группами нейронов, расположенных только на поверхности нейроструктур.
Состояние работ в области создания многоканальных соединений в развитых странах описано в литературных источниках [1-39].
В принципе, проблема создания проводящего двустороннего интерфейса между нейроном и полупроводником может быть решена с использованием принципа электрической поляризации диэлектриков [40-43]. « Если соединить нейрон и полупроводник таким образом, что непроводящая липидная мембрана будет находиться в прямом контакте с изолирующим слоем диоксида кремния, расположенном на поверхности p-n перехода, то можно получить желаемый двусторонний интерфейс. Благодаря активности нервной клетки на слой диэлектриков действует слабое электрическое поле, которое их поляризует. Прямая поляризация определяет перенос зарядов транзистора, расположенного под слоем диоксида кремния, в направлении исток-сток. С этого и начинается взаимодействие чипа и нейрона. Обратная связь достигается тем же эффектом поляризации: электрическое поле, генерируемое транзистором, поляризует мембрану нейрона, что заставляет открываться и закрываться ионные каналы, управляемые чувствительными к электрическому полю белками».
Традиционно считается, что передача нервных сигналов между нейронами осуществляется либо с помощью нейромедиаторов, либо непосредственно электрическим путем [47-49]. Однако до появления современных теорий существовала биогидравлическая модель нервных систем [50]. Она была выдвинута известным греческим мыслителем Аристотелем (384-322 до н.э.) и поддерживалась великим французским ученым Декартом (1596-1650. Ряд специфических факторов в работе нервных систем и мозга свидетельствует в пользу биогидравлической модели. «Скорость перемещения, так называемого, потенциала действия нервного импульса больше соответствует скорости распространения волны давления в вязкой жидкости и совсем не соответствует скорости распространения электричества. В коротких нервных клетках электрический потенциал действия не регистрируется. Только эластичные гидравлические каналы, какими являются каналы нервных клеток, нуждаются в упрочнении их оболочек миелином, так как оно способствует повышению скорости распространения потенциала действия, то есть волны давления. Разрушение миелиновых оболочек, как форма болезни, приводит к нестабильности в движениях человека; скорость перемещения импульсов по нейронам прямо зависит от диаметра аксона, и даже такой общеизвестный факт, как вздрагивание ноги при ударе молоточком по колену, говорит в пользу гидравлических процессов [50]».
Известна концепция Р. Пенроуза и С. Гамерова, по которой нейроны являются не первичными переключателями нервных сигналов, а сложными вычислительными устройствами, математический процесс в которых осуществляется с помощью массивов молекул протеина тубулин, составляющих стенки микротрубочек цитоскелета нейрона.
Прототип
Рассмотрим основные технологии, положенные в основу заявляемого решения.
Известна технология интеллектуальных многоконтактных соединений (ИМКС), по патенту РФ №2270493. Согласно патенту для осуществления многоконтактного соединения объединяют в специальные матрицы передатчики (выводы) прибора-источника информации, приемники (вводы) прибора-потребителя информации и концы пучка проводников сигнала. При формировании матриц не соблюдают строгий порядок пространственного расположения их элементов, и формируют их хаотически или «как получится». Матрицы передатчиков и приемников соединяют с соответствующими матрицами пучка проводников, не обязательно точно соблюдая их одинаковое взаимное расположение и добиваясь лишь совпадения областей расположения элементов матриц. Такая конструкция соединений не требует высокой точности изготовления и монтажа, что существенно снижает их стоимость и расширяет возможности массового применения. После соединения и при повреждении соединения, производят распознавание и запоминание образовавшихся каналов связи. Затем с помощью коммутаторов каналов подключают каждый распознанный и идентифицированный канал связи к вводам и выводам соединяемых приборов в соответствии с заданной таблицей или программой соединений. При повреждении соединения осуществляется самодиагностика и регенерация соединения. Применение ИМКС в нейроэлектронных интерфейсах позволяет решить целый ряд важнейших проблем. Технология ИМКС позволяет соединять одним разъемом десятки и даже сотни тысяч выводов. Так оптический кабель размером 5х5 мм, содержащий оптические волокна диаметром 17 микрон, позволяет создать интерфейс, содержащий до 20 тыс. каналов связи. (Всего в кабеле содержится 90 тыс. волокон). Этого достаточно чтобы создавать высокоэффективные протезы достаточно сложных нервов – зрительного, слухового, нервов управляющих конечностями и т.п.
Прототипом заявляемого изобретения является нейроэлектронный многоканальный интерфейс по заявке на выдачу патента РФ №2007111222 «Нейроэлектронный многоканальный интерфейс». Прототип представляет собой пакет оптических волоконных световодов со стороны ввода сигналов объединенных в плоскую оптическую матрицу соединенную оптоволоконным разъемом с многоканальной матрицей оптических излучателей. Со стороны, обращенной к нейронной структуре, каждый световод имеет наконечник, на котором сформирована активная наноструктура, генерирующая электрический или гидроакустический импульс, возбуждающий нейроны. Основным элементом активной наноструктуры является фотоэлектрический преобразователь, который преобразует импульс света, поступающий к нему по оптоволоконному световоду, в электрический импульс. Пакет световодов помещен во внешнюю оболочку обтекаемой формы, сделанную из растворимого вещества. Оболочка может иметь каналы для вспомогательных приспособлений и может иметь ответвления на разных расстояниях от оптоволоконного разъема.
Краткое описание чертежей
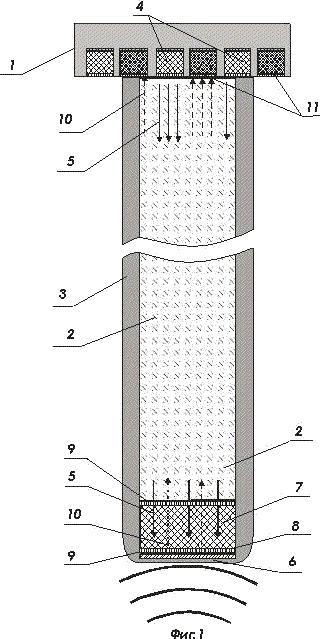
На фигуре 1 показан один оптоволоконный световод подключенный вверху к комбинированной матрице ИМКС, состоящей из светоизлучающих ячеек и фотоприемных ячеек. В нижней части рисунка показан один из вариантов активной наноструктуры
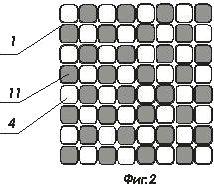
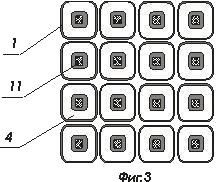
На фигурах 2 и 3 показаны варианты конструкций комбинированных матриц ИМКС
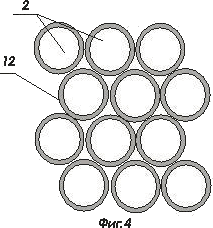
На фигуре 4 показана плоская оптическая матрица световодов
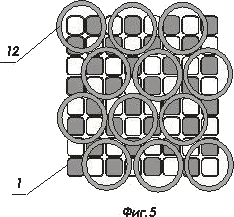
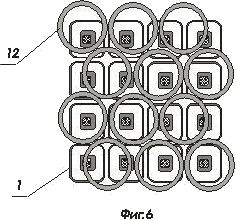
На фигуре 5 и 6 показаны варианты соединения комбинированных матриц ИМКС и оптической матрицы световодов
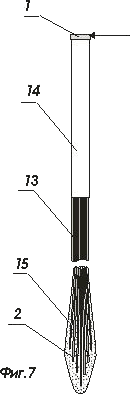
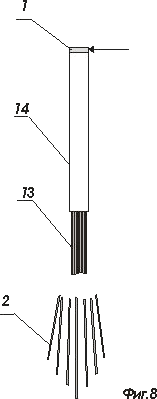
На фигурах 7 и 8 показан интерфейс в оболочке до введения и через некоторое время после введения в нейроструктуру
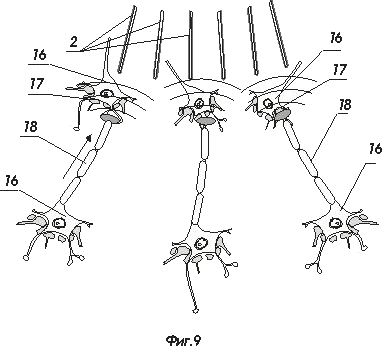
На фигуре 9 показана схема соединения заявляемого интерфейса с нейроструктурой
На фигурах 1 – 9 цифрами обозначены:
- комбинированная матрица ИМКС, состоящая из светоизлучающих ячеек и фотоприемных ячеек;
- волоконно-оптический световод ;
- оболочка волоконно-оптического световода ;
- светоизлучающая ячейка, например, светодиод или микролазер, элемент матрицы ИМКС;
- излучаемый луч света ;
- активная наноструктура;
- слой жидкокристаллического вещества, например, полимера на основе линейных или гребнеобразных разветвленных макромолекул, либо на основе молекул, содержащих парные мезогены, макромолекул с латерально связанными мезогенными группами, дискообразными и крестообразными фрагментами;
- отражающий зеркальный или диффузный слой, например, из золота или серебра, алюминия, слоев элластичного диэлектрика и т.п.;
- тонкопленочный поляризатор, слой поляризующего вещества на основе поливинилового спирта, стереорегулярных полиенов, эпоксидных олигомеров с нелинейно-оптическими хромофорными группами и т.п.
- промодулированный и отраженный луч света;
- фотоприемная ячейка, например, фотодиод или фототранзистор, элемент матрицы ИМКС;
- плоская оптическая матрица световодов;
- пакет оптических волоконных световодов;
- внешняя сплошная оболочка пакета световодов;
- наконечник из растворимого вещества
- нейрон;
- синапс ;
- аксон.
Осуществление изобретения
При нейропротезировании, например, протеза конечности, с использованием предлагаемого интерфейса, в результате постоянной тренировки нейроны управляющих областей мозга должны постепенно установить контакты с наконечниками 6, как показано на фиг. 9, т.е. точно так, как они устанавливают новые контакты с живыми нейронами. При этом аксоны конечных цепочек нейронов могут приблизиться к наконечникам 6 и даже войти в механический контакт с ними, передавая необходимую для управления информацию. При этом порядок вывода информации с областей мозга или нервного узла в нейроинтерфейс не имеет значения. Главное, чтобы этот поток информации был дискретизирован и однозначно связан с получаемой по обратной (скорее всего зрительной) связи информацией о результатах действия. Нейроны, в процессе тренировки, сами перестроятся в структуры, правильно создающие управляющее воздействие. Следовательно, методика тренировки и активизации процесса образования синаптических контактов должна базироваться на активном использовании обратной связи с протезируемым.
Предлагаемый нейроэлектронный интерфейс позволяет сделать очередной шаг на пути решения целого ряда важнейших проблем, связанных с возможностью протезирования конечностей, реабилитации парализованных, возможностью управления технологическими средствами, транспортом, оружием, прямым выводом аудио, зрительной, сенсорной и моторной информации из головного и спинного мозга, различных нервных узлов и т.п. Это позволит создать очень удобные и невидимые внешне технические средства связи между людьми, а также между людьми и компьютерами, и даже между людьми и животными.
Реально приближается осуществление давней мечты человечества – обретения возможности управления машинами с помощью мысли!
Прогноз
ИМКС – принципиально новый вид соединений в электронике. Это не просто изобретение. Это ключевое решение, позволяющее создать целый спектр электронных устройств нового поколения, которые просто не могут быть реализованы сейчас даже с помощью самой современной элементной базы.
ИМКС окажут очень сильное влияние на развитие суперкомпьютеров и найдут массовое применение в многоядерных и многопроцессорных персональных ЭВМ, которые идут на смену однопроцессорным.
Разработка ИМКС даст сильнейший импульс развитию биокибернетики.
Нейроинтерфейсы на базе ИМКС позволят объединить уникальный феномен мышления людей с мощностью и скоростью электронных машин. Глобальные информационные сети постепенно превратятся в гигантские мыслящие биоэлектронные нейросети, обладающие таким могучим интеллектом, возможности которого сейчас трудно даже представить.
Очень вероятно, что в этом заложен смысл эволюции Человечества как биологического вида, обладающего разумом. А значит, те нации, которые будут лидировать в этом процессе, будут доминировать в науке и в мировой политике.
Именно они будут побеждать в войнах будущего.
Нанотехнологии должны способствовать великому объединению биологического разума и электроники.
Справочная информация
Нейрофибриллы
Нейрофибриллы составляют опорную и дренажную систему нейронов, а также участвуют в проведении нервных импульсов.
Состоят из нейрофиламентов и нейротрубочек, образующих плотную сеть в перикарионе клетки и параллельные пучки в отростках.
Нейрофибрилла (neurofibrilla, LNH; нейро- + фибрилла) - органоид цитоплазмы нейрона, выявляемый в виде тонкой нити при обработке гистологических препаратов солями серебра.
Нейрофибриллы (от нейро... и новолат. fibrilla — волоконце, ниточка), микроскопические нити, выявляемые в нервных клетках (нейронах) и их отростках (главным образом аксонах) при обработке солями серебра и некоторыми др. реактивами. В конце 19 — начале 20 вв. Н. приписывали функцию проведения нервных импульсов. Эти взгляды оказались ошибочными: нервные импульсы проводятся наружной мембраной нейрона (см. Мембранная теория возбуждения). При электронной микроскопии в отростках нейронов обнаружены два рода продольно ориентированных Н.: трубчатые (диаметр 20—25 нм), так называемые нейротубулы, построенные из белка тубулина и, как полагают, обеспечивающие транспорт веществ по аксону, и нитевидные (диаметр 10 нм), так называемые нейрофиламенты, построенные из белка, близкого к мышечному белку актину; нейрофиламенты особенно многочисленны в подвижных концевых участках растущих аксонов.
Литература
1. Wise, K. D., Angell, J. B., and Starr, A. An integrated-circuit approach to extracellular microelectrodes. IEEE Trans Biomed Eng 17, 238-47 (1970).
2. Obeid, I., Nicolelis, M. A., and Wolf, P. D. A multichannel telemetry system for single unit neural recordings. J Neurosci Methods 133, 33-8 (2004).
3. Hijazi, N., Krisch, I., and Hosticka, B. J. Wireless power and data transmission system for a micro implantable intraocular vision aid. Biomed Tech (Berl) 47 Suppl 1 Pt 1, 174-5 (2002).
4. Wise, K. D., Anderson, D. J., Hetke, J. F., Kipke, D. R., and Najafi, K. Wireless implantable microsystems: High-density electronic interfaces to the nervous system. Proceedings of the Ieee 92, 76-97 (2004). Notes: Review.
5. Obeid, I., Nicolelis, M. A., and Wolf, P. D. A low power multichannel analog front end for portable neural signal recordings. J Neurosci Methods 133, 27-32 (2004).
6. Harrison, R. R. and Caameron, C. A Low-Power Low-Noise CMOS Amplifier for Neural Recording Applications. IEEE Journal of Solid-State Circuits 38, 958-965 (2003).
7. Obeid, I., Morizio, J. C., Moxon, K. A., Nicolelis, M. A., and Wolf, P. D. Two multichannel integrated circuits for neural recording and signal processing. IEEE Trans Biomed Eng 50, 255-8 (2003).
8. Obeid, I. and Wolf, P. D. Evaluation of spike-detection algorithms for a brain-machine interface application. IEEE Trans Biomed Eng 51, 905-11 (2004).
9. Harrison, Reid R. A Low-Power Integrated Circuit for Adaptive Detection of Action Potentials in Noisy Signals. In Proc. 2003 Intl. Conference of the IEEE Engineering in Medicine and Biology Society. 2003.
10. Watkins, Paul T., Santhanam, Gopal, Shenoy, Krishna V., and Harrison, Reid R. Validation of Adaptive Threshold Spike Detector for Neural Recording. Proceedings of te 26th Annual International conference of the IEEE EMBS.
11. Porada, I., Bondar, I., Spatz, W. B., and Kruger, J. Rabbit and monkey visual cortex: more than a year of recording with up to 64 microelectrodes. Journal of Neuroscience Methods 95, 13-28 (1931). Notes: Article.
12. Williams, J. C., Rennaker, R. L., and Kipke, D. R. Long-term neural recording characteristics of wire microelectrode arrays implanted in cerebral cortex. Brain Res Brain Res Protoc 4, 303-13 (1999). [0105] 13. Rennaker, R. L., Ruyle, A. M., Street, S. E., and Sloan, A. M. An economical multi-channel cortical electrode array for extended periods of recording during behavior. J Neurosci Methods 142, 97-105 (2005).
14. Loeb, G. E., Peck, R. A., and Martyniuk, J. Toward the ultimate metal microelectrode. J Neurosci Methods 63, 175-83 (1995).
15. deCharms, R. C., Blake, D. T., and Merzenich, M. M. A multielectrode implant device for the cerebral cortex. J Neurosci Methods 93, 27-35 (1999).
16. Schmidt, E. M., Bak, M. J., and McIntosh, J. S. Long-term chronic recording from cortical neurons. Exp Neurol 52, 496-506 (1976).
17. Taylor, D. M., Tillery, S. I., and Schwartz, A. B. Information conveyed through brain-control: cursor versus robot. IEEE Trans Neural Syst Rehabil Eng 11, 195-9 (2003).
18. Taylor, D. M., Tillery, S. I., and Schwartz, A. B. Direct cortical control of 3D neuroprosthetic devices. Science 296, 1829-32 (2002).
19. Georgopoulos, A. P., Schwartz, A. B., and Kettner, R. E. Neuronal population coding of movement direction. Science 233, 1416-9 (1986).
20. Schwartz, A. B., Moran, D. W., and Reina, G. A. Differential representation of perception and action in the frontal cortex. Science 303, 380-3 (2004).
21. Kennedy, P. R., Kirby, M. T., Moore, M. M., King, B., and Mallory, A. Computer control using human intracortical local field potentials. IEEE Trans Neural Syst Rehabil Eng 12, 339-44 (2004).
22. Kennedy, P. R., Bakay, R. A., Moore, M. M., Adams, K., and Goldwaithe, J. Direct control of a computer from the human central nervous system. IEEE Trans Rehabil Eng 8, 198-202 (2000).
23. Kennedy, P. R., Mirra, S. S., and Bakay, R. A. The cone electrode: ultrastructural studies following long-term recording in rat and monkey cortex. Neurosci Lett 142, 89-94 (1992).
24. Kennedy, P. R. and Bakay, R. A. Restoration of neural output from a paralyzed patient by a direct brain connection. Neuroreport 9, 1707-11 (1998).
25. Hoogerwerf, A. C. and Wise, K. D. A three-dimensional microelectrode array for chronic neural recording. IEEE Trans Biomed Eng 41, 1136-46 (1994). [0118] 26. Bai, Q., Wise, K. D., and Anderson, D. J. A high-yield microassembly structure for three-dimensional microelectrode arrays. IEEE Trans Biomed Eng 47, 281-9 (2000).
27. Wise, K. D. and Najafi, K. Microfabrication techniques for integrated sensors and microsystems. Science 254, 1335-42 (1991).
28. Hetke, J. F., Lund, J. L., Najafi, K., Wise, K. D., and Anderson, D. J. Silicon ribbon cables for chronically implantable microelectrode arrays. IEEE Trans Biomed Eng 41, 314-21 (1994).
29. BeMent, S. L., Wise, K. D., Anderson, D. J., Najafi, K., and Drake, K. L. Solid-state electrodes for multichannel multiplexed intracortical neuronal recording. IEEE Trans Biomed Eng 33, 230-41 (1986). 30. Vetter, R. J., Williams, J. C., Hetke, J. F., Nunamaker, E. A., and Kipke, D. R. Chronic neural recording using silicon-substrate microelectrode arrays implanted in cerebral cortex. IEEE Trans Biomed Eng 51, 896-904 (2004).
31. Kipke, D. R., Vetter, R. J., Williams, J. C., and Hetke, J. F. Silicon-substrate intracortical microelectrode arrays for long-term recording of neuronal spike activity in cerebral cortex. IEEE Trans Neural Syst Rehabil Eng 11, 151-5 (2003).
32. Campbell, P. K., Jones, K. E., and Normann, R. A. A 100 electrode intracortical array: structural variability. Biomed Sci Instrum 26, 161-5 (1990).
33. Jones, K. E., Campbell, P. K., and Normann, R. A. A glass/silicon composite intracortical electrode array. Ann Biomed Eng 20, 423-37 (1992).
34. Campbell, P. K., Jones, K. E., Huber, R. J., Horch, K. W., and Normann, R. A. A Silicon-Based, 3-Dimensional Neural Interface-Manufacturing Processes for an Intracortical Electrode Array. Ieee Transactions on Biomedical Engineering 38, 758-768 (1991). Notes: Article.
35. Normann, R. A., Maynard, E. M., Rousche, P. J., and Warren, D. J. A neural interface for a cortical vision prosthesis. Vision Res 39, 2577-87 (1999).
36. Rousche, P. J. and Normann, R. A. Chronic recording capability of the Utah Intracortical Electrode Array in cat sensory cortex. J Neurosci Methods 82, 1-15 (1998).
37. Rousche, P. J. and Normann, R. A. Chronic intracortical microstimulation (ICMS) of cat sensory cortex using the Utah Intracortical Electrode Array. IEEE Trans Rehabil Eng 7, 56-68 (1999). [0130]
38. Donoghue, J. P. Connecting cortex to machines: recent advances in brain interfaces. Nature Neuroscience 5, 1085-1088 (2002). Notes : Review Suppl . S .
39. Ласков В.Н., Чебкасов С.А. Новая методика вживления микроэлектродов в мозг мелких животных для исследований в свободном поведении Научно-исследовательский институт нейрокибернетики им. А.Б. Когана РГУ, 2005
40. Статья в CNET : http://news.com.com/Better+living--and+smarter+rats--through+chemistry/2010-7337_3-5445669.html
41. Max Planck Institute of Biochemistry in Martinsried, Department of Membrane and Neurophysics: http://www.biochem.mpg.de/mnphys/
42. Max Planck Institute of Biochemistry in Martinsried, Department of Membrane and Neurophysics: обзор "Neuroelectronic Interfacing"http://www.biochem.mpg.de/mnphys/publications
43. Свидиненко Ю. Мозг On Line: кое-что о нейрочипах 2005.05.27 http://www.nanonewsnet.ru/
44. Курцвейль Р. C лияние человека с машиной. ДВИЖЕМСЯ ЛИ МЫ К "МАТРИЦЕ"
45. Прими красную таблетку: Наука, философия и религия в "Матрице". /Под ред. Глена Йеффета. [Пер. с англ. Т. Давыдова]. -- М.: Ультра.Культура.
46. Пенроуз Р., Гамеров С. Слайд-лекция "Что такое мышление?" http://www2.usu.ru/seminar608/Slideshow/intro.htm
47. Нейрохимия / Под ред. И.П. Ашмарина, П.В. Стукалова. М.: НИИ биомедхимии РАМН, 1996. 469 с.
48. Раевский К.С., Георгиев В.П. Медиаторные аминокислоты: Нейрофармакологические и нейрохимические аспекты. М.: Медицина, 1986. 239 с.
49. Сергеев П.В., Шимановский Н.Л., Петров В.И. Рецепторы физиологически активных веществ. 2-е изд. М.; Волгоград, 1999. 639 с.
50.Антонов В. М. ОБУЧАЕМЫЕ СИСТЕМЫ УПРАВЛЕНИЯ http://www.314159.ru/neuro/
51. Свидиненко Ю. Nanosolar грозится захватить мировой рынок по производству солнечных элементов http :// www . nanonewsnet . ru / index . php ? module = Pagesetter & func = viewpub & tid =6& pid =126
52. Nanotechweb.org: Nanosolar to build world's largest solar cell factory
53.Мейтин М. Пусть всегда будет солнце.Фотовольтаика: материалы,технологии, перспективы. Журнал Электроника: Наука, Технологии, Бизнес №6,2000 г.
54. Kroon M . A ., van Swaaij R . A . C . M . M ., Zeman M ., Metselaar J . W .
Study of the Design of the a-Si:H Transverse Junction Solar Cell. – Proc. of the 2nd World Conference and Exhibition in Photovoltaic Solar Energy Conversion.
55. Nakazawa T., Kuranouchi S., Haeiwa T. CuInSe2 Thin Films Prepared by One Step Electrodeposition. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion.
56. Sommeling P.M., Spath M., Roosmalen J.A.M., Meyer T.B., Meyer A.F., Kohle O. Dye-Sensitized Nanocrystalline TiO2 Solar Cells on Flexible Substrates. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion.
57. Rudiono, Shuichi Okazaki, Manabu Takeuchi. Effects of NO2 on Photovoltaic. Performance of Phtalocyanine Thin Film Solar Cells. – Thin Solid Films, 334(1998), p.187-191.
58. Light S., Khaselev O., Ramakrishna P.A., Faiman D., Katz E.A. , Shames A., Goren S. Fullerene Photoelectrochemical Solar Cells. – Solar Energy Materials and Solar Cells, 51(1998), p.9–19.
59. Yang J., Banerjee A., Lord K., Guha S. Correlation of Component Cells with High Efficiency Amorphous Silicon Alloy Triple-Junction Solar Cells and Modules. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion.
60. Guha S. , Yang J., Banerjee A. , Glat felter T. Amorphous Silicon Alloy Solar Cells for Space Application. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion.
61. Kroll W.J., Thompson A.G., Armour E., Stal R.A., Brennan T., Hou H. MOCVD Technology for Advanced Space Solar Cell Production. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion.
62. Rannels J.F . Trends in PV Technology Development – Future Implications. – Proc. of the 2nd World Conference and Exhibition on Photovoltaic Solar Energy Conversion, p.LXXXVII.